| 〔質問〕 アボガドロ定数=6.0×1023/mol とし、次の各問に有効数字2桁で答えよ。 塩化ナトリウム NaCl 2.5mol に含まれるイオンの総数は何個か。 計算方法と答えが分かりません |
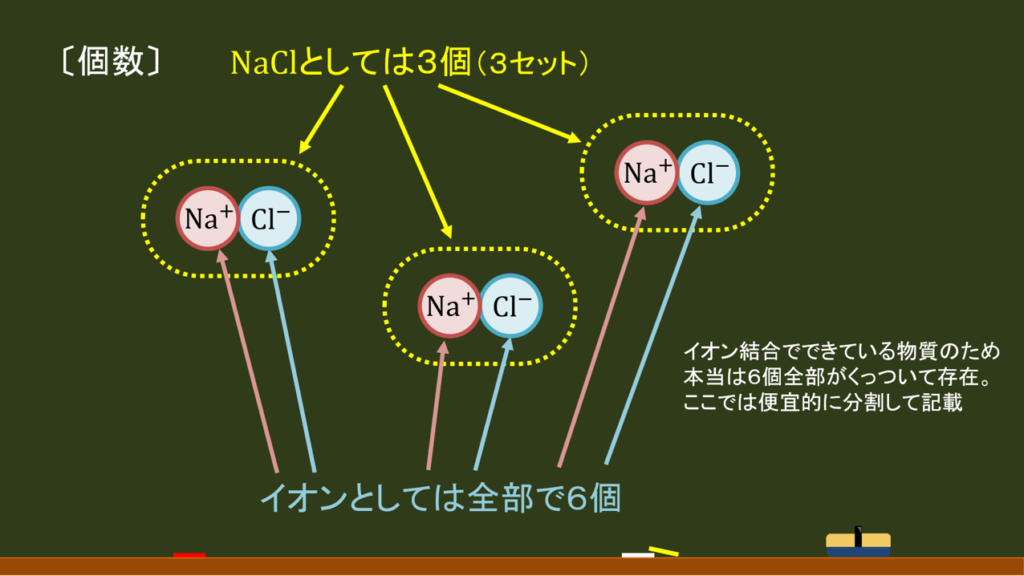
| 〔回答〕 ※ 注記の通り、答え自体は回答していませんのでご了承ください。 まず、塩化ナトリウム NaCl 1mol というのは、「Na+1個・Cl-1個」の組が、6000垓組(1023組)あるということを意味しています。垓とは億・兆・京の次に来る大きい数のことです。 以上を踏まえてまず「NaCl」というのが何組あるかを考えた上で、 以下の図の事例だと、NaClは全部で3セットありますが、イオンとしては計6個ある、というものです。 |
〔詳細〕
| ※ 理解を優先するために、あえて大雑把に書いてある場合があります |
| アンケートへのご協力をお願いします(所要2~3分) |
|---|
| 「将来設計・進路」に関するアンケートを実施しています。ご協力いただける方はこちらよりお願いします (Googleフォームにアクセスします) |