| 〔質問〕 化学反応において、反応物の持つエネルギーの総和が生成物の持つエネルギーの総和よりも大きい場合( )反応が起こる。 この答えが発熱反応なのですが、 出来ればこの式を使って説明してください。 |
| 〔回答〕 まず、この問題の答えから言うと、例えば A → B のような反応が起こる場合、 「反応物の持つエネルギーの総和が生成物の持つエネルギーの総和よりも大きい」というのは、「B の状態でいるのに、A ほどのエネルギーは必要としない」ということで、「不要なエネルギーを放出する」という意味で発熱反応になります。 式の方ですが、まず教科書等で、正しくは「反応熱=(生成物の生成熱の和)-(反応物の生成熱の和)」または「反応熱=(生成物の結合エネルギーの和)-(反応物の結合エネルギーの和)」であることを確認してください。 以下のエネルギー図でいうと、求めたい反応熱は「A」と「B」の水準の差(赤矢印の部分)で、これは生成熱の x, y を用いるなら「y-x」として求まる、というものです。 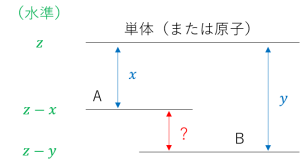 一方、今回の「反応物の持つエネルギーの総和」「生成物の持つエネルギーの総和」という言い方だと、水準の高さ自体を言っていることになりますので、 「単体(または原子)」のエネルギーの水準を仮に z とおくと、A:z-x, B:z-y で、ここから (z-x)-(z-y) という計算を行う必要があります(※ (z-y)-(z-x) ではない)。 ですので、こちらを使うのであれば「反応熱=(反応物の持つエネルギーの総和)-(生成物の持つエネルギーの総和)」ということになります。 (「A=B+?」で、移項すれば「?=A-B」) こうした違いが生じてしまう原因ですが、「生成熱」の値の扱い方が違っていることによるものです。 例えば、生成熱として x=80, y=100 のとき、差は 100-80 で 20 ということになりますが、これは「単体(または原子)から失われたエネルギー」を正の値として扱い、その上で「失われたもの同士の差」から逆算的に求めるという発想をとっていることになります。 ですが、エネルギーの総和(エネルギー図での高低)という話であれば、失われたものは負の値として、つまり、「単体(または原子)」と比較して「それぞれ -80, -100」として扱う必要があり、その上で A の水準と B の水準を比較していることになります。 そのため、最終的な答えである「20」を得るためには、(正負の扱いが逆であることに起因して)引き算の方向も逆にする必要があった、というものです。 ※ 前者は「取り出されたエネルギー」自体の比較、後者は「物質側に残っているエネルギー」の比較 |
| ※ 理解を優先するために、あえて大雑把に書いてある場合があります |
|---|
| アンケートへのご協力をお願いします(所要2~3分) |
|---|
| 「将来設計・進路」に関するアンケートを実施しています。ご協力いただける方はこちらよりお願いします (Googleフォームにアクセスします) |

